Резюме
Ведение. Врожденный синдром удлиненного интервала QT (long QT syndrome – LQTS) представляет собой нарушение реполяризации миокарда желудочков, характеризующееся удлинением интервала QT на электрокардиограмме (ЭКГ), которое может привести к симптомным желудочковым нарушениям ритма сердца и повышенному риску внезапной сердечной смерти (ВСС). Синдром LQT сопряжен с повышенным риском манифестации характерной жизнеугрожающей сердечной аритмии, известной как torsades de pointes, или «пируэт». LQTS может быть врожденным или приобретенным.
Цель – изучить обстоятельства диагностики врожденного синдрома LQT у детей Воронежской области, проанализировать возраст манифестации, клинические проявления, параметры ЭКГ и подтипы синдрома у детей.
Материал и методы. В исследование были включены 13 детей с врожденным удлиненным интервалом QT. Пациенты были разделены на 2 группы: 1-я – симптомные, 2-я – бессимптомные. Представлены результаты ретроспективного анализа обстоятельств выявления, семейный анамнез, клиническая картина, результаты ЭКГ, эхокардиографии (ЭхоКГ) и холтеровского мониторирования (ХМ), показатели выживаемости детей с LQTS по данным историй болезней и амбулаторных карт Воронежской областной детской клинической больницы № 1 (ВОДКБ № 1).
Результаты. Всем детям 1-й группы проводилось лечение бета-адреноблокаторами. Двум детям с диагнозом синдром Джервелла–Ланге-Нильсона (JLNS) и с 1 молекулярно-генетическим вариантом LQTS Романо–Уорда (RW) были имплантированы кардиовертеры-дефибрилляторы. За период наблюдения с 2013 по 2020 г. ни один ребенок не погиб.
Заключение. Врожденный синдром LQT у детей – редкое наследственное заболевание, сопряженное с высоким риском ВСС. Очевидна необходимость тщательного анализа амбулаторных ЭКГ с соблюдением методики определения интервала QT.
Введение
Синдром удлиненного интервала QT (Long QT syndrome – LQTS) – это врожденное заболевание сердца – генетически гетерогенная совокупность наследственных нарушений реполяризации миокарда, связанных общим клиническим фенотипом удлинения интервала QT на ЭКГ покоя и высоким потенциальным риском угрожающих жизни сердечных аритмий. LQTS является наследственным первичным электрическим нарушением, известным как сердечная каналопатия, которая предрасполагает к внезапной сердечной смерти (ВВС) в отсутствие структурного заболевания сердца. Интервал QT на поверхностной ЭКГ представляет собой сумму длительностей потенциала действия отдельных кардиомиоцитов желудочков и, следовательно, является суррогатным маркером аномальной реполяризации клеточных мембран. Двумя кардинальными проявлениями LQTS являются синкопальные эпизоды, которые могут привести к остановке сердца и ВВС, а также электрокардиографический паттерн, включающий удлинение интервала QT и аномалии зубца Т.
Клинические симптомы включают ощущение приступов внезапного учащенного сердцебиения, обмороки и гипоксические судороги, вторичные по отношению к желудочковой тахиаритмии, классической является тахикардия torsade de pointes (TdP) Повышенная предрасположенность к злокачественным аритмиям сердца обусловлена ионной кардиопатией, которая приводит к отсроченной реполяризации потенциала действия кардиомиоцитов желудочков. Распространенность заболевания P.J. Schwartz et al. оценивали примерно в 1 на 2000 здоровых живорожденных детей.
Термин «синдром Роман – Уорда» (Romano-Ward syndrome – RWS) относится к формам синдрома удлиненного интервала QT с исключительно сердечным фенотипом, наследуемым по аутосомно-доминантному типу. Две наследственные формы идиопатического LQTS являются аутосомно – рецессивными при синдроме Джервелла—Ланге-Нильсена (Jervell – Lange – Nielsen syndrome – JLNS), сопровождающиеся глубокой нейросенсорной тугоухостью. В современной литературе RWS используется взаимозаменяемо с LQTS.
Впервые о синдроме LQST, вероятно, сообщил в 1856 г. F. Meinssner, описавший глухую девочку, которая упала в обморок и умерла во время публичного выговора в школе. Первое полное описание врожденного LQTS представили A. Jervell, F. Lange – Nielsen в 1957г., они сообщили о семье с четырьмя глухонемыми детьми с обмороками, внезапной смертью и длительными интервалами QT – рецессивная форма заболевания, связанная с глухотой.
В 1985г. P.J. Schwartz et al. впервые опубликовали данные о естественном течении заболевания и выявленной смертности до 71% у нелеченых пациентов с периода манифестации первого обморока. В настоящее время, в эру общепринятой медикаментозной терапии, смертность среди пациентов с LQTS составляет 0,3%.
Генетическая основа заболевания была идентифицирована в середине 1990-х годов XX века. Наша современность ознаменована созданием баз данных мутаций генов человека (HGMD), включающих всеобъемлющую информацию о мутациях ядерных генов, лежащих в основе или связанных с наследственными заболеваниями человека.
На данный момент LQTS классифицирован на 17 подтипов на основе мутаций, связанных с 15 аутосомно-доминантными генами LQT1-15, два из них — наследуемые по аутосомно-рецессивному типу JLNS 1-го и 2-го типов. Все верифицированные до настоящего времени гены LQTS кодируют субъединицы ионных трансмембранных каналов или белки, участвующие в модулировании ионных токов в кардиомиоцитах. Наиболее распространенными формами являются LQT1 и LQT2 (мутации в калиевых каналах) LQT3 (мутации в натриевых каналах). Полагают, что все гены LQTS функционально связаны с тремя сердечными ионными токами: IKs, IKr и INa. Дисфункция этих трех ионных токов, вызванная либо субъединицей канала, либо мутациями вспомогательного белка, видимо, является «последним общим путем» для манифестации LQTS.
Наиболее распространенным подтипом является LQT1 поражающим до 30—35% индивидуумов с LQTS и возникающим из-за потери функции гена KCNQ1 кодирующего α - субъединицу потенциал-управляемого калиевого канала Kv7.1 (KvLQTS OMIM *607542), экспрессируемого в клеточной мембране кардиомиоцитов. Трансмембранный калиевый канал Kv7.1 опосредует активируемый ток замедленного выпрямления калия (IKs). Канальный комплекс Kv7.1 состоит из четырех α - субъединиц, образующих тетрамер (шейкерный тип), которые объединяются с двумя β -субъединицами, кодируемыми геном KCNE1 для генерации тока IKs, модулирующего длительность потенциала действия в кардиомиоцитах, другими словами — контролирующего процесс реполяризации желудочков. KCNQ1 α-субъединица имеет потенциал чувствительный домен (S1-S4), трансмембранные поровые домены (S5-S6), а также внутриклеточный (цитозольный) N- и C- терминал и адаптерный белок Yotiao. Мутации с участием этого гена приводят к уменьшению тока реполяризации IKs и удлинению интервала QT.
LQT1 проявляется на поверхностной ЭКГ в виде широкого и симметричного зубца Т с удлиненным интервалом QТс. Частота манифестации опасных для жизни событий — самая низкая у больных LQT1 по сравнению с пациентами с подтипами LQT2 или LQT3. Бета-блокаторы наиболее эффективны у пациентов с этим подтипом для предотвращения жизнеопасных желудочковых аритмий. В настоящее время описано более 600 вариантов мутаций в гене KCNQ1, вызывающих LQT1. Целый ряд исследований был посвящен изучению выявления значимых корреляций генотип—фенотип, которые позволили диагностировать у больных эго потенциально опасное для жизни заболевание. Расположение конкретной мутации LQT1 в структуре ионного канала может быть напрямую связано с риском сердечного события. Наличие мутации в структуре С-терминали создает наибольший риск остановки сердца или BCC. В то же время некоторые исследователи выдвигают предположение, что может существовать стратегия, позволяющая избежать терапии бета-блокаторами у лиц с низким уровнем риска ВСС с LQT1, у которых отсутствует мутация в С-терминали, однако данное утверждение требует дальнейшего изучения.
Учитывая характерные особенности LQTS, типичные случаи не представляют диагностических трудностей для врачей, осведомленных о заболевании. Однако пограничные случаи являются более сложными и требуют оценки различных электрокардиографических, клинических и семейных данных, как это предлагается в конкретных диагностических критериях. Методика измерения интервала QТ на поверхностной ЭКГ покоя, коррекция интервала относительно частоты сердечных сокращений (ЧСС) и критерии постановки диагноза широко описаны в доступной литературе. Кроме того, молекулярно-генетический скрининг теперь является частью диагностического поиска.
Клинические проявления заболевания довольно драматичны, так как включают синкопальные эпизоды, которые часто приводят к остановке сердца и внезапной смерти и обычно возникают в условиях физического или эмоционального стресса у здоровых в остальном молодых людей, в основном детей и подростков. Синкопальные эпизоды связаны с манифестацией полиморфной желудочковой тахикардии с характерным поворотом комплекса QRS вокруг изоэлектрической базовой линии TdP, часто трансформирующейся в фибрилляцию желудочков (ФЖ). Следует отметить, что TdP или ФЖ могут начинаться без изменений ЧСС и без определенных последовательностей, таких как интервал short-long-short, даже если длительные паузы у пациентов с LQTS увеличивают вероятность TdP. Поскольку ВСС может быть первым симптомом болезни, ранняя диагностика становится критически необходимой.
Электрокардиограммы многих пациентов с LQTS обычно не представляют трудностей в интерпретации. Удлинение интервала QT не ограничивается просто продлением реполяризации желудочков. Зубец Т имеет несколько морфологических паттернов, которые должны легко идентифицироваться на основании клинического опыта. Их сложно определить количественно, но оценка их морфологии очень существенна для диагностики. Как правило, чем длительнее интервал QТ, тем выше риск развития злокачественных аритмий, и многочисленные данные указывают на то, что при QTc более 500—550 мс существует определенное увеличение риска.
Диагностика LQTS базируется на основании характеристик ЭКГ, клинических проявлений, индивидуального и семейного анамнезов. В 1985 г. P.J. Schwartz предложил диагностические критерии врожденного LQTS, которые в последующем изменялись. В настоящее время для постановки диагноза врожденного LQTS рекомендуются диагностические критерии, представленные в табл.1
Принято полагать, что самым мощным предиктором высокого риска ВСС у пациентов с LQTS является продолжительность интервала QT. В ряде исследований были показаны несколько факторов риска ВСС, которые были определены в порядке убывания величины, включая LQTS с увеличенным интервалом QТс (QТс ⩾550 мс), анамнез сердечных событий (обмороки или предотвращенная остановка сердца), LQTS 3, женский пол, LQTS 2 и брадикардия.

Открытие факта, что различные варианты LQTS связаны с генами, кодирующими разные субъединицы ионных каналов, оказало критическое влияние на диагностику, анализ, стратификацию риска и лечение пациентов с LQTS. Клинические данные выявили различные факторы риска, связанные с различными генотипами LQTS. Современная профилактическая терапия больных LQTS с целью снижения частоты обмороков и ВСС включает бета-блокаторы, имплантированные дефибрилляторы и, реже, левостороннюю симпатическую ганглионэктомию.
Материал и методы
Были собраны демографические данные, семейный анамнез, клинические проявления у детей с врожденным удлиненным интервалом QТ. Рассматриваемые характеристики пациентов включали пол, возраст на момент постановки диагноза, наличие или отсутствие обморока, судороги, остановку сердца. Были рассмотрены данные стационарных историй болезни и амбулаторных карт ВОДКБ № 1.
Паттерны ЭКГ и клинические характеристики были проанализированы в момент установления диагноза и контролировались с возрастом у детей с врожденным синдромом удлиненного интервала QТ в период с 2013 по 2020г. Диагноз LQTS и определение продолжительности интервала QT были основаны на оценке детского кардиолога ВОДКБ № 1, владеющего функциональной диагностикой, и врачом функциональной диагностики других медицинских организаций. Для постановки окончательного диагноза использовалась система оценок, опубликованная в 1993 г. P.J. Schwartz еt аl. Включенные в исследование дети соответствовали диагностическим критериям LQTS (оценка P.J. Schwartz, A.J. Moss 3 и более). Данный подход аналогичен опубликованному самому последнему консенсусному заявлению экспертов HRS/EHRA/APHRS. Мы обозначили совокупный диагностический балл LQTS, который определялся на основе корригированного интервала QТ (QTс), симптомов и семейного анамнеза.
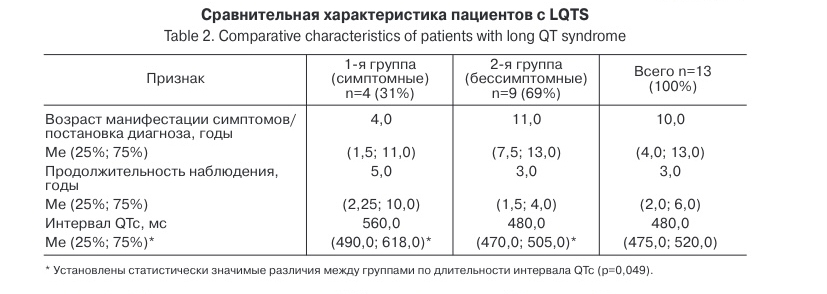
В исследование было включено 13 пациентов с удлиненным интервалом QТ в возрасте от 1 года до 15 лет — 8 женского пола и 5 мужского. Средний возраст пациентов 10,0 (4,0; 13,0) лет. Средняя продолжительность интервала QТ у больных составила 480,0 (475,0; 520,0) мс.
Клинические характеристики пациентов были сгруппированы по наличию или отсутствию клинических симптомов и триггерным событиям. Пациенты были разделены на 2 группы: симптомные дети, у которых зарегистрированы события (синкопе, судороги, происходящие в состоянии покоя или нагрузки, вызванные адренергической стимуляцией, например, стресс, физические нагрузка или испуг) или сердцебиения — 1-я группа; пациенты с врожденным удлиненным интервалом QТ — бессимптомные — 2-я группа. Пациенты 1-й группы и некоторые пациенты 2-й группы были проконсультированы в Центре синкопальных состояний и сердечных аритмий у детей и подростков Федерального медико-биологического агентства России (ЦСССА ФМБА России), руководитель - д.м.н., профессор Л. М. Макаров. Клинические характеристики и данные ЭКГ проанализированы и сравнивались между данными группами.
Всем детям проведено физикальное обследование, выполнены поверхностная ЭКГ покоя в 12 отведениях, ЭхоКГ, холтеровское мониторирование.
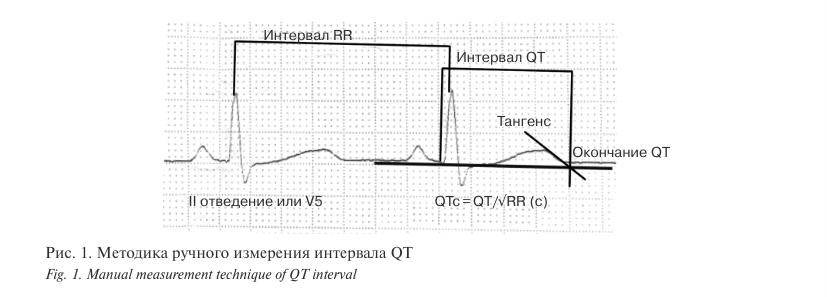
Предпочтительным для анализа ЭКГ было II отведение. Отведение V5 использовалось как альтернативное. Электрокардиограммы были проанализированы ручным измерением интервала QТ с помощью метода тангенса или касательной к нисходящей зубца Т (методика предложена в 1952 г. E. Lepeschkin, B. Surawicz), обеспечивающим диагностическую точность.
Предельные значения, основанные на 95-м и 99-м процентилях контрольной популяции и 1-м и 5-м процентилях пациентов с LQTS, были установлены на основе метода коррекции сердечного ритма, возраста и пола. В ручном режиме оценивали временную шкалу на ЭКГ для калибровки и впоследствии определяли интервал РQ, длительность QRS, RR-интервал/частоту сердечных сокращений и интервал QТ в отмеченных комплексах в миллисекундах (мс). Интервал QТ был измерен от начала комплекса QRS до конца волны Т с использованием касательного (тангенсального) метода. Второй компонент волны Т (Т2) всегда включался в интервал QT а волна U всегда исключалась из анализа интервалов QT кроме случая ребенка с синдромом Андерсена—Тавила (LQTS7), где определялись интервалы QТ и QU по общепринятым параметрам. Конец волны Т методом построения касательной линии был определен как точка, в которой касательная линия к самой крутой конечной нисходящей терминали волны Т пересекается с изоэлектрической базовой линией. Изоэлектрическая линия была получена путем соединения сегмента ТР (сегмент между волной Т и волной Р) комплекса, в котором измерялся интервал QT с сегментом ТР предыдущего комплекса. Интервал RR между измеренным QТ и предыдущим комплексом QRS был использован для получения интервала QТс по формуле Н.С. Bazett. Оценка LQTS была определена в соответствии с диагностическими критериями LQTS, описанными ранее. Диагностические критерии включали интервал QТс (450 мс), как минимум 1 симптомный эпизод (например, брадикардия, сердцебиение, синкопе) или семейный анамнез LQTS.
Эхокардиография проводилась по общепринятой методике с целью выявления структурных аномалий в сердце. Холтеровское мониторирование выполняли согласно Национальным российским рекомендациям.
Генотипирование и консультация генетика выполнены в лаборатории медицинской генетики Российского научного центра хирургии им. академика Б. В. Петровского в период с 1998 по 2017 г. Метод прямого секвенирования по Сэнгеру был использован для последовательной идентификации генетических вариантов KCNQ1 и KCNE1. Секвенирование всего экзома (WES) использовали для идентификации вариантов всех других известных генов LQTS: KCNQJ, KCNEJ, KCNE2, KCNE3, KCNJ2, KCNH2, SNTA1, SCN5A, SCN1B, SCN3B, SCN4B.
Детям, которых первоначально обследовали и лечили в неврологическом отделении, были выполнены электроэнцефалография и магнитно-резонансная томография головного мозга и другие исследования, по необходимости они были консультированы сурдологом.
Статистический анализ
Описательную статистику и сравнительный анализ данных выполняли с использованием статистического пакета IВМ SPSS Statistics, версия 22. Количественные признаки представлены в виде медианы и интерквартильного размаха (25-й и 75-й процентили). Сравнение количественных показателей между двумя независимыми группами осуществлялось с использованием критерия Манна—Уитни. Различия между группами считались статистически значимыми при р<0,05.
Результаты
Исследование представляет собой обзор отдельных клинических случаев детей с врожденным удлиненным интервалом QТ в ВОДКБ № 1.
В 1-й группе было 4 симптомных пациента, из них 2 мужского пола и 2 — женского. У 3 детей был выявлен экстремально удлиненный интервал QТ — свыше 600 мс, из них у 1 ребенка был диагностирован синдром Джервелла—Ланге-Нильсона (LQTS5) и у 1 — генетически подтвержденный синдром Андерсена—Тавила (LQTS7). Наиболее злокачественное течение заболевания наблюдалось у ребенка с JLNS, первый синкопальный эпизод был зарегистрирован в возрасте 1 года. Во 2-ю группу были включены 9 пациентов: 3 больных мужского пола и 6 женского пола. Выявлено статистически значимое различие продолжительности интервала QТ между группами.
Все пациенты 1-й группы первоначально обследовались и лечились в неврологическом отделении с диагнозом эпилепсия, так как первыми симптомами у них были синкопальные состояния, сопровождавшиеся судорогами. Из них 3 детей были генотип-позитивными — выявлен 1 молекулярно-генетический вариант LQTS, синкопальные состояния у них впервые возникли в возрасте 3—5 лет, средняя продолжительность интервала QТс составила 560±45 мс.
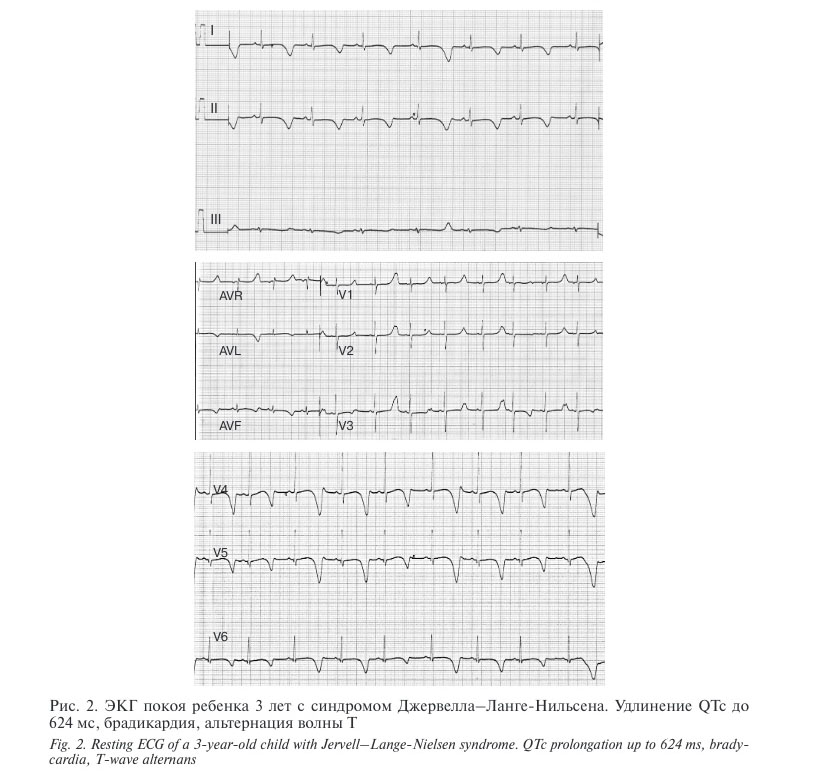
У 1 пациентки (девочки 3 лет) диагностирован JLNS, синкопальные состояния манифестировали в возрасте 1 года, с этого момента она наблюдалась у невролога. Синкопальные состояния рецидивировали в дневное время на фоне активных игр и эмоций до 3—4 раз в год. В возрасте 3 лет консультирована детским кардиологом и сурдологом ВОДКБ № 1, установлен диагноз JLNS, удлиненный интервал QТ, рецидивирующие синкопальные состояния, двусторонняя врожденная нейросенсорная тугоухость IV ст. На ЭКГ покоя: брадикардия — ЧСС 75 уд/мин, интервал QТс 624 мс, глубокие отрицательные волны Т во всех отведениях, выраженная альтернация Т от слабо положительного до глубокого отрицательного в 4—5 последовательных циклах.
У симптомных детей средний балл по критериям P.J. Schwartz (2009 г.) составил 6.
Синдром JLNS — это редкое аутосомно-рецессивное заболевание, характеризующееся двусторонней нейросенсорной тугоухостью и длительным интервалом QТc (более 500 мс), которое может привести к возникновению ТdР и ВСС. Это один из наиболее неблагоприятных подтипов наследственного LQTS сопряженный с высоким риском ВСС в раннем возрасте. По разным данным, предполагаемая распространенность составляет 1:6—8 млн. Больной была назначена терапия бета-адреноблокатором с элевацией дозы до 2 мг/кг. Однако было очевидно, что монокомпонентной терапии в данном случае будет недостаточно.
Учитывая слабый эффект проводимой медикаментозной терапии, высокие потенциальные риски ВСС, ребенок был консультирован в ЦСССА ФМБА России профессором, д.м.н. Л.М. Макаровым и направлен в Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева. В возрасте 4 лет пациентке с целью первичной профилактики ВСС, согласно рекомендациям, был имплантирован кардиовертер-дефибриллятор.
У пациентки с синдромом RWS в возрасте 3 лет впервые манифестировали длительные (несколько минут) синкопальные состояния, сопровождающиеся диффузным цианозом, судорогами. На ЭКГ покоя интервал QТс составлял 564 мс, отмечались глубокие отрицательные волны Т во II, V4—V6 отведениях, альтернация зубца Т. При генетическом обследовании выявлена патогенная мутация р.G589D (GLY589ASP; ОМIМ: 607542,0029) в гетерозиготном состоянии в гене KCNQ1, характерная для 1-го молекулярно-генетического варианта LQTS. Миссенс-мутация p.G589D означает замену глицина на аспарагиновую кислоту в позиции (кодоне) 589 в цитозольной С-терминали. Данная мутация в гене KCNQ1 (KCNQ1-Fin) впервые была идентифицирована К. Рippo et аl. в 2001 г. у финских больных с фенотипом JLNS 1-го типа в гомозиготном состоянии и у пациентов с фенотипом RWS в гетерозиготном состоянии. Исследователи пришли к выводу, что мутация G589D отмечается в 30% случаев у финских больных с синдромом удлиненного интервала QТ и может быть связана как с фенотипами синдрома Романо—Уорда, так и Джервел- ла—Ланге—Нильсена. В ряде исследований было показано, что наиболее неблагоприятное течение с высоким риском ВСС характерно для больных с мутациями в гене KCNQ1 в трансмембранной и С-терминальной областях, при этом показана высокая эффективность бета-адреноблокаторов у этих пациентов. Этим и объясняется манифестация синкопальных состояний у ребенка и агрессивное течение LQTS. Также обнаружена замена p.Q107H в этом же гене в гетерозиготном состоянии. Данная мутация располагается в домене датчика напряжения KCNQ1 α -субъединицы и интерпретируется как «вариант неизвестною значения», роль в дисфункции канала в настоящее время активно изучается. Проводится постоянная терапия бета-адреноблокатором, которая оказалась крайне эффективна. На фоне лечения синкопальные состояния не регистрировались уже в течение последних 5 лет, что соответствует данным литературы. Наличие частых тяжелых длительных обморочных состояний у ребенка стало прямым показанием для приобретения наружного дефибриллятора.
У пациента 8 лет с синдромом RWS синкопальные состояния с кратковременными судорогами манифестировали в возрасте 8 лет, больной впервые был госпитализирован и обследован также в неврологическом отделении ВОДКБ № 1 в связи с судорожным синдромом. Так как на стандартной ЭКГ покоя был выявлен удлиненный интервал QTс — 495 мс, пациент был консультирован детским кардиологом. Назначена стандартная терапия бета-адреноблокатором, которая оказалась недостаточно эффективна, синкопальные пароксизмы продолжали манифестировать. Генетическое обследование не проводилось. Пациент был консультирован руководителем ЦСССА ФМБА России д.м.н., профессором Л.М. Макаровым. В 10 лет пациенту был имплантирован кардиовертер - дефибриллятор. На фоне коррекции образа жизни, физической активности, медикаментозной терапии состояние пациента стабилизировалось. Случаи срабатывания кардиовертера-дефибриллятора крайне редки.
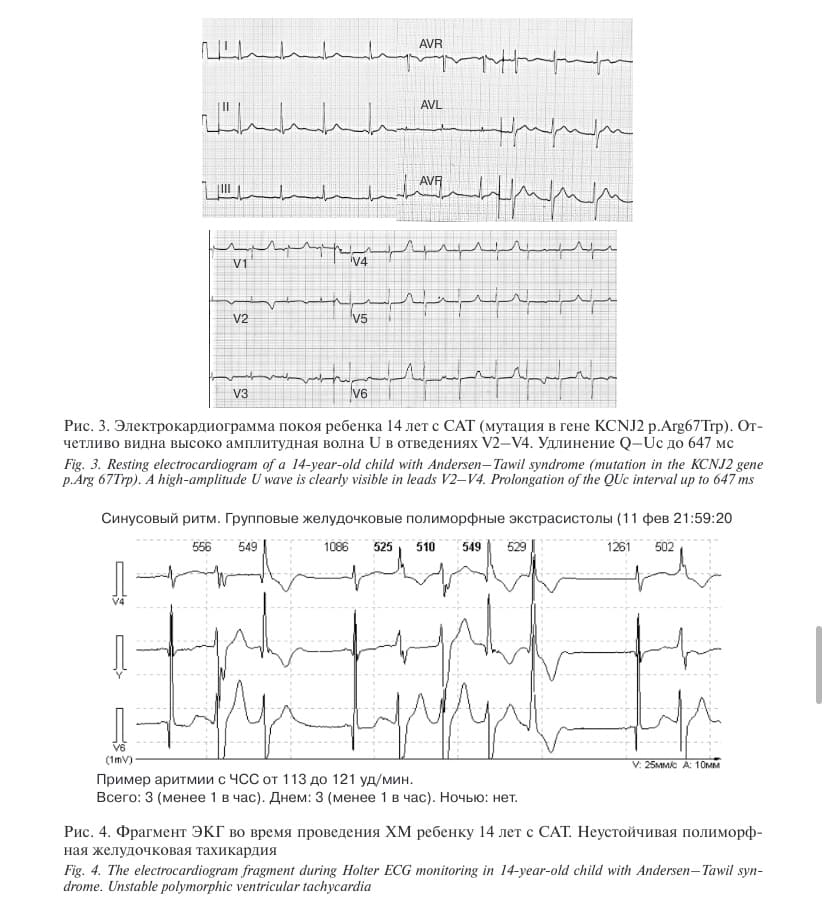
У пациента 13 лет с генетически подтвержденным диагнозом синдром Андерсена—Тавила (САТ) типичным ЭКГ-паттерном отмечались синусовая брадиаритмия, выраженная волна U с характерным переходом волны Т в U, удлинение QТс 460 мс и интервалом QUс 647 мс, желудочковая тахикардия, экстрасистолия.
Синдром Андерсена—Тавила, классифицируемый как синдром LQT 7-го типа (LQTS7), является редким мультисистемным заболеванием, спорадическим или наследуемым по аутосомно-доминантному типу. Мутации, вызывающие САТ, лежат в гене KCNJ2 (регистрационный номер GenBank NМ_000891.2), цитогенетическое местоположение — хромосома 17q24,3, который кодирует «α-субъединицу калиевого канала Kir2.1, компонент реполяризующего тока калия IK1 кардиомиоцита. Мутации KCNJ2 выявляются у 60% пациентов с данным синдромом. САТ характеризуется клинической триадой: желудочковая аритмия, периодический паралич или мышечная слабость, выраженный дисморфизм лица и скелета с изменчивостью фенотипа. Сердечные проявления САТ включают частые полиморфные желудочковые экстрасистолы, удлинение интервала QU, выраженные U-волны и особый тип полиморфной желудочковой тахикардии — ТdР.
У пациентов с CAP L. Zhang еt аl. описали аномальную заметную U-волну и увеличенный интервал QТ— U, но не удлинение интервала QТ. Они показали, что аномальная волна Т—U присутствовала у 91% пациентов с мутациями CAT-KCNJ2. Эти нарушения включали: удлиненную конечную часть зубца Т, выявляемую примерно в 70% случаев; широкий Т—U-волновой переход — в 43% случаев; двухфазную U-волну — в 16% случаев; большую U-волну — в 73% случаев.
Пациент, 14 лет, впервые консультирован детским кардиологом ВОДКБ № 1 после генетического обследования и выявленной характерной мутации в гене KCNJ2, кодирующем калиевый канал кардиомиоцитов и поперечной мускулатуры. В неврологическом отделении наблюдался и лечился в течение 2 лет с диагнозом «периодический паралич (гипокалиемическая форма). Сирингомиелия шейного и «грудного отделов спинного мозга». На ЭКГ покоя выявляется типичный ЭКГ-паттерн, синусовая брадиаритмия, удлиненный интервал QТс 490 мс, выраженная волна U с характерным переходом волны Т в U и интервалом QUc 647 мс.
Жалобы на выраженную мышечную слабость, сердцебиение. Только у этого пациента при проведении ХМ зарегистрирована характерная неустойчивая полиморфная желудочковая тахикардия, экстрасистолия.
У пациента отмечали упорный миоплегический синдром с постоянной слабостью в мышцах ног, невозможностью присесть, провоцируемые незначительной физической нагрузкой пароксизмы резкой слабости, настолько выраженной, что ребенок до 3 сут. не мог встать с постели. В биохимических показателях крови во время одного пароксизма в стационаре выявлена гипокалиемия до 2,5 ммоль/л. Для уточнения формы данного синдрома пациент был консультирован медицинским генетиком, принято решение о медико-генетическом обследовании. В мае 2019 г. были получены данные ДНК-анализа крови по панели «Наследственные миоплегии» (Центр молекулярной генетики, г. Москва) от 13.12.2018 г.: выявлен вариант нуклеотидной последовательности в экзоне 2 гена KCNJ2 (Chr17: 68171379С>Т) в гетерозиготном состоянии, ранее описанный G. Andelfinger еt а1. как патогенный (СМ022029), приводящий к замене аминокислоты в 67-м положении белка (p.Arg67Trp, NМ_000891.2).
Миссенс-мутации в гене KCNJ2 в гетерозиготном состоянии описаны у пациентов с синдромом Андерсена (ОМIМ: 613980) и синдромом короткого интервала QT 3-го типа. Типичной триадой у ребенка являлись внешние аномалии дисморфогенеза (широко поставленные глаза, широкая переносица, гипоплазия нижней челюсти, синдактилия II и III пальцев ног, сколиоз и др.), миплегия с пароксизмами резкой миоплегии, ЭКГ-паттерн. Терапия, проводимая пациенту, включала препараты калия, ацетозоламид и бета-адреноблокатор.
У всех пациентов 1-й группы на ЭКГ выявились синусовая брадикардия, соответствующая 2 – 5-му перцентилю, укорочение интервала PQ – 0,1 ± 0,026 мс.
При выполнении эхокардиографии у детей в 1-й группе (симптомные пациенты) дефект межпредсердной перегородки с незначительным объемом шунтируемой крови без дилатации правых камер сердца и нормальными показателями расчетного давления в легочной артерии выявлен только у 1 пациента с JLNS. У других детей этой группы структурных изменений в сердце не обнаружено.

Холтеровское мониторирование, выполняемое в стационаре и в амбулаторных условиях, позволило зарегистрировать полиморфную желудочковую экстрасистолию и неустойчивую полиморфную желудочковую тахикардию только у одного ребенка с САТ в 1-й группе.
Во 2-ю группу были включены бессимптомные пациенты (n=9) с удлиненным интервалом QТс. Средний возраст на момент установления диагноза составил 10,0 (4,0; 13,0) лет. Из них двое занимались в спортивных секциях. Во всех случаях диагноз установлен детскими кардиологами ВОДКБ № 1, тогда как при профилактических осмотрах детей в школах и других медицинских организациях удлинение QТ на ЭКГ не было выявлено.
У большинства бессимптомных детей 2-й группы интервал QТс не превышал 500 мс, у 6 детей составил более 480 мс, совокупный балл по шкале P.J. Schwartz еt а1. — более 3. В этой группе превалировали пациенты женского пола — 5.
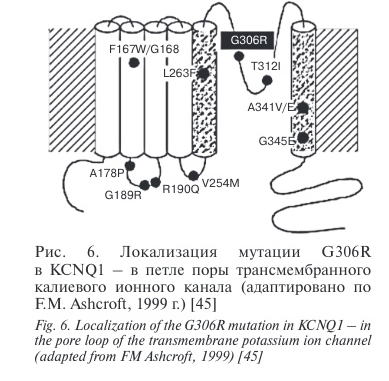
Среди этих детей можно выделить пациентку с экстремально удлиненным интервалом QТс, которой в настоящее время 8 лет, без жалоб и зарегистрированных сердечных событий. Удлинение интервала QT выявлено в раннем возрасте – около 1 года. Интервал QТс продолжительностью 520 мс по морфологии комплекса QRST предположительно соответствует LQT3. Однако выполненное генетическое обследование позволило выявить у ребенка мутацию в гене KCNQ1 в гетерозиготном состоянии p. G306R, ответственном за LQT1 молекулярно-генетический вариант.
Опираясь на данные результатов по изучению стратификации риска у больных LQTS, топологию канала Кv7.1, функциональные последствия аритмогенного эффекта мутации G306R KvLQT1 K+ канала, генотип и клинические характеристики синдрома, можно полагать, что течение заболевания у этой пациентки относительно благоприятно.
Известно, что мутация RWS G306R оказывает доминантно-негативное влияние на активность канала KvLQT1 в гетерологичной (не свойственной для данной) системе экспрессии, избыточная экспрессия конструкции, несущей эту мутацию в кардиомиоцитах, должна снижать или устранять нативные IKs, если KvLQT1 действительно является основным молекулярным компонентом этого сердечного тока. Мутация G306R затрагивает трансмембранные домены, эквивалентные S5 и S6 KCNQ1, но ее точная локализация — петля поры, согласно данным F.M. Ashcroft (1999 г.), что, возможно, способствует более мягкому фенотипу этих мутаций. Становится очевидным отсутствие у пациентки с экстремально удлиненным интервалом QТс каких-либо сердечных событий длительное время — около 8 лет без терапии бета-блокаторами. В настоящее время ребенок регулярно наблюдается в отделении ВОДКБ № 1, получает терапию бета-блокатором 0,7 мг/кг, жалоб нет. С другой стороны, как показано выше, в исследованиях установлено, что у пациентов с мутациями, локализованными в трансмембранной области и миссенс-мутациями С-терминали в канале KCNQ1, частота сердечных событий значительно выше, чем с другой локализацией, и существует высокий риск возникновения опасных для жизни событий. В то же время отмечен выраженный положительный эффект от лечения бета-блокаторами этих больных.
Результаты ряда исследований последних лет подчеркивают важность понимания молекулярных детерминант и механизмов, лежащих в основе аритмогенеза, для выявления сердечных факторов риска для пациентов с LQT1.
Обсуждение
Врожденный синдром удлиненного интервала QТ — редкое наследственное заболевание сердца, связанное с риском развития злокачественных желудочковых аритмий. Диагностика LQTS в типичных случаях может быть сложной. Первой манифестацией заболевания возможна ВСС. Удлинение интервала QТ на ЭКГ в состоянии покоя является патогномоничным паттерном заболевания, но до трети носителей мутации могут иметь нормальные интервалы QТ на ЭКГ в покое.
Исследования LQTS за последние два десятилетия расширили наши знания о механизме, лежащем в основе синдрома, а также о вариантах лечения, специфичных для генотипа. Постоянной проблемой для диагностики является LQTS с нормальным или пограничным QTc в покое. В таких случаях клинически важны диагностические тесты для выявления дезадаптации интервала QТ к ЧСС. Обновленная система оценки в 2011 г. в настоящее время включает оценку интервала QТ в периоде восстановления после стресс-теста. Генетическое тестирование на сердечно-ионные мутации в области каналопатии в настоящее время является важным компонентом диагностической оценки и каскадного семейного скрининга.
Наше исследование — первое, демонстрирующее клинические электрокардиографические характеристики, лечение и наблюдение детей с врожденным LQTS в Воронежской области. Врожденный синдром LQT у детей — редкое наследственное заболевание, сопряженное с высоким риском ВСС. Выявляемость LQTS при профилактических осмотрах, регистрации и оценке ЭКГ у детей низкая, что, вероятно, обусловлено слабой настороженностью педиатров и врачей функциональной диагностики. Недооценка удлинения интервала QТ может существенно повысить риск развития у больных угрожающих жизни тахиаритмий и внезапной смерти. Симптомные дети чаще первоначально обследуются у невролога, так как показатели интервала QТ на ЭКГ у этих детей были недооценены. Очевидна необходимость тщательного анализа амбулаторных ЭКГ с соблюдением методики определения интервала QТ. В большинстве случаев возможно благоприятное течение заболевания у бессимптомных пациентов с удлинением интервала QТс менее 500 мс, негативным семейным анамнезом по ВСС, однако они требуют тщательного наблюдения, корректной физической нагрузки, терапии бета-блокаторами. Очевидно, что существует группа детей с экстремально удлиненным интервалом QТ и высоким риском ВСС, требующие как можно более раннего выявления LQTS и применения терапии, вплоть до трехкомпонентной.
У большинства симптомных пациентов в нашем исследовании отмечались экстремальные показатели интервала QТс, сердечные симптомы манифестировали в раннем возрасте во время нагрузки или эмоционального стресса.
Генетическое обследование позволяет не только выявить мутацию в гене, ответственном за LQTS, но и различные клинически значимые корреляции генотип—фенотип, определить диагностические подходы, стратегии стратификации риска и терапевтических вмешательств.
Выводы
Врожденный синдром LQT у детей — редкое наследственное заболевание, сопряженное с высоким риском ВСС. Очевидна необходимость тщательного анализа амбулаторных ЭКГ с соблюдением методики определения интервала QТ.
Кондрыкинский Егор Львович, кмн, детский кардиолог МЦ «Детский Доктор»